

岭南现代临床外科 ›› 2019, Vol. 19 ›› Issue (05): 528-532.DOI: 10.3969/j.issn.1009-976X.2019.05.004
陈景森1, 欧希2, 赵洋3, 余光银3, 刘晓平2*
CHEN Jingsen1, OU Xi2, ZHAO Yang3, YU Guangyin3, LIU Xiaoping2
摘要:
调节性T细胞(regulatory T cells,Treg)是重要的抑制性免疫调节细胞,通过产生具有抑制功能的细胞因子来发挥其免疫抑制作用,在维持免疫稳态中起着重要作用[1]。Treg细胞通过两种机制促进免疫逃避:免疫无反应和免疫抑制;它们降低机体对肿瘤抗原的识别,诱导与免疫无反应相关的肿瘤抗原的免疫耐受,并负性调节与之相关的抗肿瘤免疫反应。免疫抑制,导致恶性肿瘤的免疫逃逸[2]。以往对Treg细胞的研究主要集中在CD4+CD25+Treg、Th3和Tr1细胞。近年来,基于细胞表面标志潜态相关性肽链(cell surface marker latency-associated peptide,LAP)的存在,发现了一种具有免疫抑制功能的新的Treg细胞亚群,因此将其命名为LAP+CD4+T细胞[3]。动物研究表明,LAP+CD4+T细胞参与了几种自身免疫和炎症疾病的发生和发展[4,5]。在临床实践中,LAP+CD4+T细胞与肿瘤有密切关系[6]。然而,迄今为止,LAP+CD4+T细胞在肝细胞癌(HCC)中的分布仍有待确定。本研究主要分析了肝癌组织、癌旁组织及正常肝脏组织中,LAP+CD4+T细胞的分布特点及差异,探讨其在肝细胞癌(hepatocellular carcinoma,HCC)局部免疫微环境中的作用。
Zongyang county of Anhui province LI Ya-xing ZHENG Li-bo WANG Tao(62)
28例肝癌患者为北京大学深圳医院肝胆外科2011年10月至2012年12月期间行肝切除术的患者,均为乙肝病毒携带者。术后病理证实为原发性肝细胞癌,术前均未接受包括经肝动脉栓塞化疗在内的任何其它治疗。其中男性16例,女性12例,年龄42至60岁,平均年龄(51±9.06)岁。组织病理对照组患者28例,均为同期因良性病变而行肝切除病例,乙肝病毒携带者。其中男性16例,女性12例,年龄在35~52岁,平均年龄在(48±13.12)岁。所有患者均无糖尿病、甲状腺功能亢进等自身免疫性疾病。性别、年龄等方面的差异无统计学意义(P>0.05)。
20 m脚内侧运球过杆数据上,可以发现试验后实验班与对照班在20 m脚内侧运球过杆的平均时间上均有明显的进步,合作学习法和传统的教学方法都可以提高运球过杆技术,但样本T检验后发现,其p值<0.05,差异非常显著,说明实验班采用合作学习模式所取得的成绩要明显好于对照班。
研究方案经医院伦理委员会批准。所有入组患者在手术前均被告知标本取材可能出现的风险及对患者健康状况可能产生的影响等,并签署知情同意书。
数据用均数±标准差,肝癌组与癌旁组采用成对样本检验,肝癌组、癌旁组与对照组均采用独立样本检验,数据都用SPSS 17.0软件包进行处理,检验水准α=0.05。
1.4.2 实验步骤 常规脱蜡水化;油笔划圈后滴加胃蛋白酶,37℃温箱25 min,PBS洗5 min×2次;3%H2O2室温20 min,PBS洗2次,5 min+10 min;胎牛血清1~2滴/片,37℃温箱30 min;即用型CD4兔抗人单克隆抗体1滴/片,4℃过夜,PBS洗2次,5 min+10 min;快捷型酶标羊抗兔 IgG 1~2滴/片,37℃温箱30 min,PBS洗2次,5 min+10 min;链霉菌抗生物素蛋白-过氧化酶1~2滴/片,37℃温箱30 min,PBS洗2次,5 min+10 min;DAB显色4 min,水洗3~4次终止染色;3%H2O2室温20 min,PBS洗2次,5 min+10 min;胎牛血清1~2滴/片,37℃温箱中 30 min;LAP 羊抗人多克隆抗体 1∶100,4℃过夜,PBS洗2次,5 min+10 min;快捷型酶标兔抗羊IgG 1~2滴/片,37℃温箱30 min,PBS洗2次,5 min+10 min;链霉菌抗生物素蛋白-过氧化酶1~2滴/片,37℃温箱 30 min,PBS洗 2次,5 min+10 min;AEC显色4 min,水洗3~4次终止染色;常规脱水、透明、封片,镜检。
1.4.1 主要试剂 LAP羊抗人多克隆抗体购自R&D公司,使用时稀释为1∶100;即用型CD4兔抗人单克隆抗体、快捷型酶标羊抗兔IgG、快捷型酶标兔抗羊IgG、链霉菌抗生物素蛋白-过氧化酶、AEC显色试剂盒、DAB显色试剂盒均为福州迈新公司产品。
LAP是一种与TGF-β氨基末端非共价结合的前肽[7],TGF-β的活化是通过部分或全部酶切LAP来实现的[8]。在小鼠脑脊髓膜炎、过敏性炎症、Ⅱ型糖尿病、结肠炎、关节炎、系统性红斑狼疮和动脉粥样硬化模型中已证实LAP+CD4+T细胞的免疫抑制作用。Oida等人[9]利用山羊LAP抗体鉴定了细胞表面表达LAP+CD4+T细胞。与LAP-CD4+T细胞相比LAP+CD4+T细胞产生更多的TGF-β和IL-10,这些细胞因子对Treg细胞在几个系统中的免疫调节作用很重要。在小鼠自身免疫性脑脊髓炎模型中,Ochi等人[10]发现CD4+CD25+LAP+T细胞比CD4+CD25+LAP-T细胞表达TGF-β和更多的Foxp3和细胞毒性T淋巴细胞相关蛋白4,并在体外和体内发挥更强的免疫抑制作用。在一个关节炎小鼠模型中,LAP+CD4+T细胞被诱导在关节中分泌IL-10,以抑制关节炎特异性反应性T细胞增殖、特异性抗体的产生和关节炎的发展[11]。与小鼠关节炎模型中的LAP+CD4+T细胞不同,系统性红斑狼疮和糖尿病模型中诱导的LAP+CD4+T细胞以TGF-β依赖性方式抑制T辅助细胞的发育,以减轻疾病[12,13]。以上研究不仅揭示了免疫抑制作用的普遍性,而且提示了免疫抑制的分化。例如,TGF-β主要作用于系统性红斑狼疮、糖尿病和脑脊髓炎模型,关节炎模型分泌高水平的IL-10抑制效应T细胞,而TGF-β和IL-10共同作用于结肠炎模型。
从表1可见,肝癌组、癌旁组以及正常对照组中LAP+CD4+T细胞单个高倍视野平均数分别为(11.25±3.00)、(5.75±1.00)及(2.61±0.83);肝癌组与正常对照组比较,差异有统计学意义(t=14.683,P=0.000);癌旁组与正常对照组比较,差异有统计学意义(t=12.751,P=0.000);癌旁组与肝癌组比较,差异亦有统计学意义(t=9.361,P=0.000)
从行肝脏切除术患者获取新鲜肝组织,用福尔马林固定,常规石蜡包埋,连续切取4 μm厚的切片。其中肝癌患者的标本分别取肿瘤组织及癌旁组织(距癌结节2 cm以内),避开坏死区,分别入乙肝肝癌组及乙肝癌旁组。对照组取因良性病变行肝切除的正常肝组织。
LAP定位于CD4+T细胞的胞浆和胞膜上(图1)。正常肝组织及癌旁组织中LAP+CD4+T细胞以散在方式分布(图2及图3),而在癌组织中多数以簇丛状方式聚集分布于肿瘤间质内,与其它淋巴细胞紧密接触(图4)。
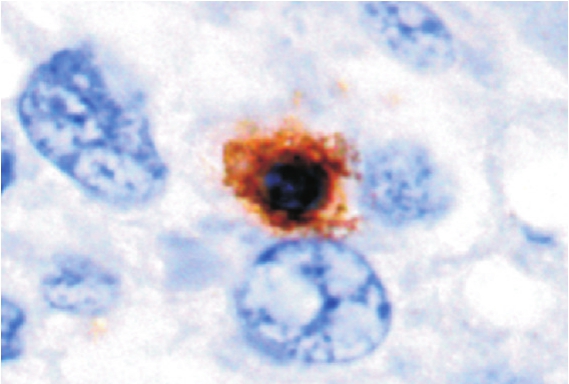
图1 LAP+CD4+T细胞阳性标准图(×1 000)
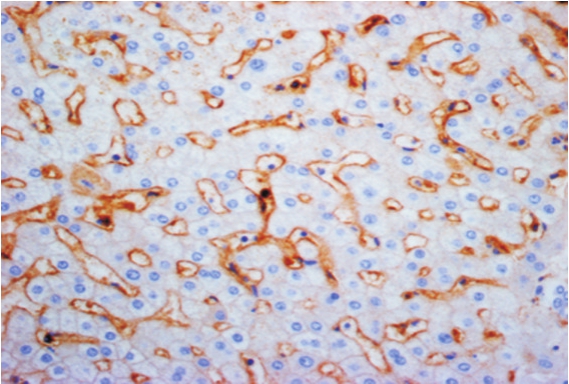
图2 LAP+CD4+T细胞在正常对照组织的分布(高倍视野,400×)
与卷包车间对应,烟草MES的咀棒车间与卷包车间对接,采用咀棒发射生产模式的基础上,建立成型机数据采集系统,实现生产状态实时跟踪与监控,实现设备运行数据、在线质量数据和产量数据的自动采集。在数采系统的基础上,建立咀棒车间生产管理系统,全面实现咀棒生产过程的精细化管理。

图3 LAP+CD4+T细胞在癌旁组织的分布(高倍视野,400×)
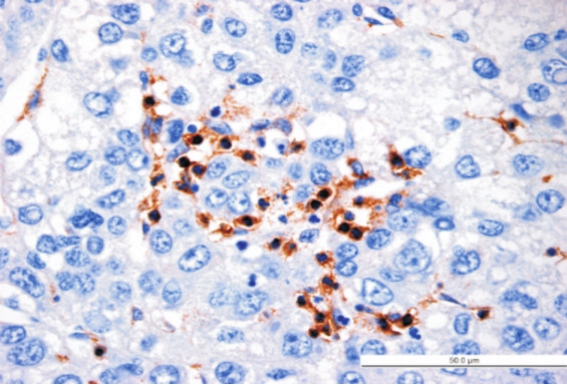
图4 LAP+CD4+T细胞在肝癌组织的分布(高倍视野,400×)
表1 肝癌组、癌旁组和对照组LAP+CD4+T细胞数量分布情况?s)

注:*与对照组比较采用两个独立样本T检验,P=0.000;**与对照组比较采用两个独立样本T检验,P=0.000;**与*比较采用配对样本t检验,P=0.000;差异均具有统计学意义
?
LAP+CD4+T细胞阳性标准(图1):细胞形态完整,结构清晰,棕黄色和紫红色颗粒特异性同时定位于胞浆和胞膜上(棕褐色颗粒);CD4+T细胞阳性标准:形态完整,结构清晰,棕黄色阳性颗粒特异性定位于胞浆和胞膜上。将切片置于显微镜下采用盲法进行观察,先在低倍镜下观察整张切片,随机选择5个高倍视野(400×)计数阳性细胞,并求平均值。
临床肿瘤研究框架中,Mahalingam等[6]发现大肠癌患者PBMCs和实体瘤组织中LAP+CD4+T细胞的表达水平明显高于非肿瘤组织;肝细胞癌细胞株中LAP+CD4+T细胞的比例也高于正常对照组,其机制可能与 IL-8、TGF-β和/或 Foxp3有关。Akiba等人[14]还报告了肝癌患者外周血和7个肝癌细胞系中IL-8表达异常升高,证明了肝癌细胞分泌大量的IL-8。Gandhi等[15]的研究证实显示IL-8是最有效的LAP+CD4+T细胞活化刺激因子。以上结果表明,肝癌患者外周血中的IL-8是激活LAP+CD4+T细胞的调节剂,是通过LAP+CD4+T细胞负性调节肿瘤免疫的重要因素。几乎所有类型的肿瘤细胞都分泌TGF-β包括肝癌和HepG2人肝癌细胞株。Chen等[3]报道,活化的LAP+CD4+T细胞分泌TGF-β,在LAP+CD4+T细胞的负性免疫调节中具有重要作用。Foxp3+Treg细胞是T细胞亚群,具有显著的负调节细胞免疫功能。Foxp3+Treg细胞的异常表达已在各种炎症病理和肿瘤类型中得到证实[16]。Foxp3+Treg细胞能够抑制肿瘤的免疫功能,提高肿瘤细胞的免疫耐受能力,对肿瘤的免疫逃避具有重要意义。但有报道LAP+CD4+T细胞水平升高伴随着Foxp3+Treg细胞数量的增加,推断在LAP+CD4+T细胞表达的Foxp3的重要调节功能。
原发性肝癌患者免疫功能低下,肿瘤局部免疫微环境异常导致机体不能正常发挥免疫防御反应,产生免疫逃逸、转移和复发。既往临床研究已经证实肝癌患者的外周血和肿瘤组织中存在异常增高的发挥免疫抑制效应的Treg细胞[17]。Treg细胞在肿瘤组织中的浸润程度代表了机体肿瘤免疫抑制反应的一个方面,在机体免疫调节中起重要作用,是导致肿瘤免疫耐受甚至免疫逃逸的一种关键机制。LAP+CD4+T细胞在炎性反应中如关节炎、结肠炎及Ⅱ型糖尿病等的模型中,发挥着重要的免疫抑制作用,影响疾病的发展[3-5,11]。Mahalingam等[6]在结肠癌患者的外周血及组织中发现LAP+CD4+T细胞异常增高,与患者CEA水平、肿瘤的临床进展和转移相关,这些细胞发挥免疫抑制作用是部分依赖TGF-β作用。本实验研究表明,肝癌微环境中LAP+CD4+T细胞聚集,多以簇丛状方式分布,浸润数量在肝癌组与癌旁组、癌旁组与正常对照组之间的比较,统计学差异均具有显著性。提示LAP+CD4+T细胞在肝组织中的分布具有异质性,愈接近肿瘤部位浸润程度愈明显。因此我们推测肿瘤特异性的LAP+CD4+T细胞可引起组织局部免疫微环境的变化,导致免疫监视逐渐减弱,有利于肿瘤细胞的增殖及转移。或许不久的将来,肝癌组织中的LAP+CD4+T细胞数量可能作为判断肝细胞癌预后的指标之一。
本研究所有的研究对象均为2016年到2018年我院血透中心的所有医护人员,共计选择15名护理人员进行分层管理,根据《护士岗位管理实施方案》的相关规定,并且根据我科的实际情况对于血液透析室的护理人员岗位管理制度进行制定,通过合理的方案进行落实,对于各个层级护理人员岗位职责和工作要求进行落实。
调节性T细胞在分子水平可能通过多种机制介导肿瘤的免疫逃避,有研究表明CD4+CD25+Treg细胞通过细胞与细胞的接触(cell-to-cell contact)及细胞因子非依赖的机制来介导免疫抑制,IL-10及TGF-β也可能是肿瘤微环境改变的参与因素[18]。LAP+CD4+T细胞在HCC微环境中的分布具有异质性,LAP定位于CD4+T细胞的胞浆和胞膜,在癌组织中多以簇丛状方式聚集分布,与其它淋巴细胞紧密接触。因此,推测LAP+CD4+T细胞可能通过细胞与细胞接触的方式抑制效应T细胞的增殖,促进肿瘤细胞逃避机体的抗肿瘤免疫反应。
[1] Sayour EJ,McLendon P,McLendon R,et al.Increased proportion of FoxP3+regulatory T cells in tumor infiltrating lymphocytes is associated with tumor recurrence and reduced survival in patients with glioblastoma[J].Cancer Immunol Immunother,2015,64(4):419-427.
[2] Yuan CH,Sun XM,Zhu CL,et al.Amphiregulin activates regulatory T lymphocytes and suppresses CD8+T cell-mediated anti-tumor response in hepatocellular carcinoma cells[J].Oncotarget,2015,6(31):32138-32153.
[3] Chen ML,Yan BS,Bando Y,et al.Latency-associated peptide identifies a novel CD4+CD25+regulatory T cell subset with TGFbeta-mediated function and enhanced suppression of experimental autoimmune encephalomyelitis[J].J Immunol,2008,180(11):7327-7337.
[4] Duan W,So T,Mehta AK,et al.Inducible CD4+LAP+Foxp3-regulatory T cells suppress allergic inflammation[J].J Immunol,2011,187(12):6499-6507.
[5] Ilan Y,Maron R,Tukpah AM,et al.Induction of regulatory T cells decreases adipose inflammation and alleviates insulin resistance in ob/ob mice[J].Proc Natl Acad Sci U S A,2010,107(21):9765-9770.
[6] Mahalingam J,Lin YC,Chiang JM,et al.LAP+CD4+T cells are suppressors accumulated in the tumor sites and associated with the progression of colorectal cancer[J].Clin Cancer Res,2012,18(19):5224-5233.
[7] Miyazono K,Ten Dijke P,Ichijo H,Heldin CH.Receptors for transforming growth factor-beta[J].Adv Immunol,1994,55:181-220.
[8] McMahon GA,Dignam JD,Gentry LE.Structural characterization of the latent complex between transforming growth factor beta 1 and beta 1-latency-associated peptide[J].Biochem J,1996,313(Pt 1):343-351.
[9] Oida T,Zhang X,Goto M,et al.CD4+CD25-T cells that express latency-associated peptide on the surface suppress CD4+CD45RBhigh-induced colitis by a TGF-beta-dependent mechanism[J].J Immunol,2003,170(5):2516-2522.
[10]Ochi H,Abraham M,Ishikawa H,et al.Oral CD3-specific antibody suppresses autoimmune encephalomyelitis by inducing CD4+CD25-LAP+T cells[J].Nat Med,2006,12(6):627-635.
[11]Wu HY,Maron R,Tukpah AM,Weiner HL.Mucosal anti-CD3 monoclonal antibody attenuates collagen-induced arthritis that is associated with induction of LAP+regulatory T cells and is enhanced by administration of an emulsome-based Th2-skewing adjuvant[J].J Immunol,2010,185(6):3401-3407.
[12]Wu HY,Quintana FJ,Weiner HL.Nasal anti-CD3 antibody ameliorates lupus by inducing an IL-10-secreting CD4+CD25-LAP+regulatory T cell and is associated with down-regulation of IL-17+CD4+ICOS+CXCR5+follicular helper T cells[J].J Immunol,2008,181(9):6038-6050.
[13]Ishikawa H,Ochi H,Chen ML,et al.Inhibition of autoimmune diabetes by oral administration of anti-CD3 monoclonal antibody[J].Diabetes,2007,56(8):2103-2109.
[14]Akiba J,Yano H,Ogasawara S,et al.Expression and funtion of interleukin-8 in human hepatocellular carcinoma[J].Int J Oncol,2001,18(2):257-264.
[15]Gandhi R,Farez MF,Wang Y,et al.Cutting edge:human latency-associated peptide+T cells:a novel regulatory T cell subset[J].J Immunol,2010,184(9):4620-4624.
[16]Brunner SM,Itzel T,Rubner C,et al.Tumor-infiltrating B cells producing antitumor active immunoglobulins in resected HCC prolong patient survival[J].Oncotarget,2017,8(41):71002-71011.
[17]韩晓东,杜贻豹,狄建忠,等.TGF-1和Treg细胞在肝细胞癌患者外周血中表达及意义[J].中国现代普通外科进展,2012,15(5):374-376.
[18]Miyara M,Sakaguchi S.Natural regulatory T cells:mechanisms of suppression[J].Trends Mol Med,2007,13(3):108-116.
Distribution characteristics of LAP+CD4+T cells in the tumor microenvironment of hepatocellular carcinoma and its significance
中图分类号: